 2017年普通高等学校招生全国统一考试(江苏卷)
2017年普通高等学校招生全国统一考试(江苏卷)
化学
注 意 事 项
考生在答题前请认真阅读本注意事项及各题答题要求
1.本卷满分为120分,考试时间为100分钟。考试结束后,请将本试卷和答题卡一并交回。
2.答题前,请务必将自己的姓名、准考证号用0.5毫米黑色墨水的签字笔填写在试卷及答题卡的规定位置。
3.请认真核对监考员在答题卡上所粘贴的条形码上的姓名、准考证号与本人是否相符。
4.作答选择题,必须用2B铅笔将答题卡上对应选项的方框涂满、涂黑;如需改动,请用橡皮擦干净后,再选涂其他答案。学科.网作答非选择题,必须用0.5毫米黑色墨水的签字笔在答题卡上的指定位置作答,在其他位置作答一律无效。
5.如需作图,须用2B铅笔绘、写清楚,线条、符号等须加黑、加粗。
可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56 Cu 64 Zn 65 Ag 108
选 择 题
单项选择题:本题包括10小题,每小题2分, 共计20分。每小题只有一个选项符合题意。 1. 2017 年世界地球日我国的主题为“节约集约利用资源,倡导绿色简约生活”。下列做法应提倡的是
A.夏天设定空调温度尽可能的低
B.推广使用一次性塑料袋和纸巾
C.少开私家车多乘公共交通工具
D.对商品进行豪华包装促进销售
2. 下列有关化学用语表示正确的是
A. 质量数为31的磷原子: 3115P
B. 氟原子的结构示意图: ![]()
C. CaCl2的电子式: ![]()
D.明矾的化学式: Al2(SO4)3
3. 下列有关物质性质与用途具有对应关系的是
A. Na2O2吸收CO2产生O2 ,可用作呼吸面具供氧剂
B. ClO2具有还原性,可用于自来水的杀菌消毒
C. SiO2硬度大,可用于制造光导纤维
D. NH3易溶于水,可用作制冷剂
4.下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是
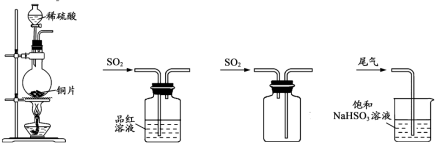
A.制取SO2 B.验证漂白性 C.收集SO2 D.尾气处理
5.短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素。下列说法正确的是
A.原子半径: r(X) < r(Y) < r(Z) < r(W)
B. W的最高价氧化物的水化物是一种弱碱
C. Y的单质的氧化性比Z的强
D. X、Y、Z 三种元素可以组成共价化合物和离子化合物
6. 下列指定反应的离子方程式正确的是
A. 钠与水反应: Na +2H2O![]() Na++2OH– + H2↑
Na++2OH– + H2↑
B. 电解饱和食盐水获取烧碱和氯气: 2Cl–+2H2O![]() H2↑+ Cl2↑+2OH–
H2↑+ Cl2↑+2OH–
C. 向氢氧化钡溶液中加入稀硫酸: Ba2++OH– + H+ + ![]()
![]() BaSO4↓+H2O
BaSO4↓+H2O
D. 向碳酸氢铵溶液中加入足量石灰水: Ca2++![]() +OH–
+OH–![]() CaCO3↓+H2O
CaCO3↓+H2O
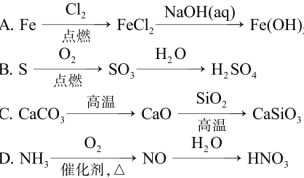
7. 在给定条件下,下列选项所示的物质间转化均能实现的是
8.通过以下反应可获得新型能源二甲醚(CH3OCH3 )。下列说法不正确的是
①C(s) + H2O(g)![]() CO(g) + H2 (g) ΔH1 = a kJ·mol-1
CO(g) + H2 (g) ΔH1 = a kJ·mol-1
②CO(g) + H2O(g)![]() CO2 (g) + H2 (g) ΔH 2 = b kJ·mol-1
CO2 (g) + H2 (g) ΔH 2 = b kJ·mol-1
③CO2 (g) + 3H2 (g)![]() CH3OH(g) + H2O(g) ΔH 3 = c kJ·mol-1
CH3OH(g) + H2O(g) ΔH 3 = c kJ·mol-1
④2CH3OH(g)![]() CH3OCH3 (g) + H2O(g) ΔH 4 = d kJ·mol-1
CH3OCH3 (g) + H2O(g) ΔH 4 = d kJ·mol-1
A. 反应①、②为反应③提供原料气
B. 反应③也是 CO2资源化利用的方法之一
C. 反应CH3OH(g)![]()
![]() CH3OCH3 (g) +
CH3OCH3 (g) +![]() H2O(l)的ΔH =
H2O(l)的ΔH =![]() kJ·mol-1
kJ·mol-1
D. 反应 2CO(g) + 4H2 (g) ![]() CH3OCH3 (g) + H2O(g)的ΔH = ( 2b + 2c + d ) kJ·mol-1
CH3OCH3 (g) + H2O(g)的ΔH = ( 2b + 2c + d ) kJ·mol-1
9. 常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中: Fe3+、Mg2+、SCN –、Cl –
B. c(H+)/ c(OH–) = 1×10 -12的溶液中: K+、Na +、![]() 、
、![]()
C. c(Fe2+ ) =1 mol·L-1的溶液中: K+、![]() 、
、![]() 、
、![]()
D. 能使甲基橙变红的溶液中: Na+、![]() 、
、![]() 、
、![]()
10. H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
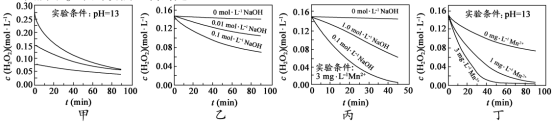
A. 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B. 图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C. 图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D. 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11. 萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是

A. a和b都属于芳香族化合物
B. a和c分子中所有碳原子均处于同一平面上
C. a、b和c均能使酸性KMnO4溶液褪色
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
12. 下列说法正确的是
A. 反应N2 (g) +3H2 (g) ![]() 2NH3 (g)的ΔH < 0,ΔS >0
2NH3 (g)的ΔH < 0,ΔS >0
B. 地下钢铁管道用导线连接锌块可以减缓管道的腐蚀
C. 常温下,Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+ )≤5.6×10-4 mol·L-1
D. 常温常压下,锌与稀H2SO4反应生成11.2 L H2,反应中转移的电子数为6.02×1023
13. 根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向苯酚溶液中滴加少量浓溴水、振荡,无白色沉淀 | 苯酚浓度小 |
B | 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解 | 部分Na2SO3被氧化 |
C | 向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液;未出现银镜 | 蔗糖未水解 |
D | 向某黄色溶液中加入淀粉 KI 溶液,溶液呈蓝色 | 溶液中含 Br2 |
14. 常温下,Ka (HCOOH)=1.77×10-4,Ka (CH3COOH)=1.75×10-5,Kb (NH3·H2O) =1.76×10-5,下列说法正确的是
A. 浓度均为0.1 mol·L-1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和: 前者大于后者
B. 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C. 0.2 mol·L-1 HCOOH 与 0.1 mol·L-1 NaOH 等体积混合后的溶液中: c(HCOO-) + c(OH-) = c(HCOOH) + c(H+)
D. 0.2 mol·L-1 CH3COONa 与 0.1 mol·L-1盐酸等体积混合后的溶液中(pH<7): c(CH3COO-) > c(Cl- ) > c(CH3COOH) > c(H+)
15. 温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应: 2NO2(g) ![]() 2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v (NO2 )消耗= k正c2(NO2 ),v逆= v(NO)消耗= 2v (O2 )消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。
2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v (NO2 )消耗= k正c2(NO2 ),v逆= v(NO)消耗= 2v (O2 )消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。
下列说法正确的是
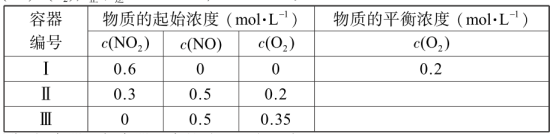 A. 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为 4∶5
A. 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为 4∶5
B. 达平衡时,容器Ⅱ中 c(O2 )/ c(NO2 ) 比容器Ⅰ中的大
C. 达平衡时,容器Ⅲ中 NO 的体积分数小于50%
D. 当温度改变为 T2时,若 k正=k逆,则 T2> T1
非 选 择 题
16. (12分)铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融 Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。
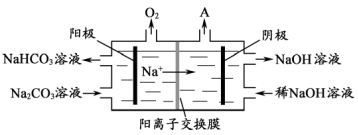
阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
17.(15分)化合物H是一种用于合成γ-分泌调节剂的药物中间体,其合成路线流程图如下:
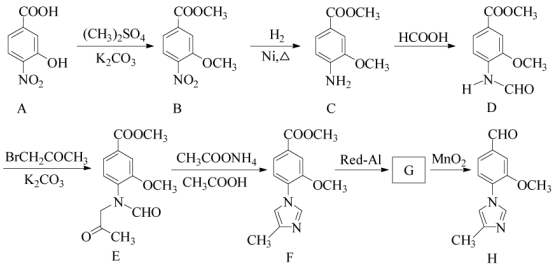
(1)C中的含氧官能团名称为_______和__________。
(2)D→E 的反应类型为__________________________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式:_____________________。 ①含有苯环,且分子中有一个手性碳原子;②能发生水解反应,水解产物之一是α-氨基酸,另一水解产物分子中只有2种不同化学环境的氢。
(4)G 的分子式为C12H14N2O2 ,经氧化得到H,写出G的结构简式:__________________。
(5)已知: ![]() (R代表烃基,R'代表烃基或H) 请写出以
(R代表烃基,R'代表烃基或H) 请写出以![]() 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
18. (12 分)碱式氯化铜是重要的无机杀菌剂。
(1)碱式氯化铜有多种制备方法
①方法1: 45 ~ 50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2·3H2O, 该反应的化学方程式为_________________________。
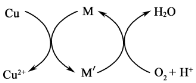
②方法2: 先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。 M'的化学式为______。
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。 为测定某碱式氯化铜的组成, 进行下列实验: ①称取样品1.1160 g,用少量稀HNO3溶解后配成100.00 mL溶液A; ②取25. 00 mL溶液A,加入足量AgNO3溶液,得AgCl 0. 1722 g;③另取25. 00 mL溶液A,调节pH 4 ~ 5,用浓度为0.08000 mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++ H2Y2-![]() CuY2-+2H+),滴定至终点,消耗标准溶液30.00 mL。通过计算确定该样品的化学式(写出计算过程)。
CuY2-+2H+),滴定至终点,消耗标准溶液30.00 mL。通过计算确定该样品的化学式(写出计算过程)。
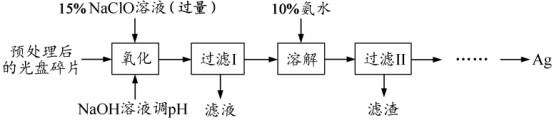
19. (15分)某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含 量过低,对实验的影响可忽略)。
 已知:①NaClO溶液在受热或酸性条件下易分解,如: 3NaClO
已知:①NaClO溶液在受热或酸性条件下易分解,如: 3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
②AgCl可溶于氨水:AgCl+2NH3·H2O![]() Ag(NH3) 2++ Cl- +2H2O
Ag(NH3) 2++ Cl- +2H2O
③常温时 N2H4·H2O(水合肼)在碱性条件下能还原 Ag(NH3) 2+ :
4 Ag(NH3) 2++N2H4·H2O![]() 4Ag↓+ N2↑+ 4
4Ag↓+ N2↑+ 4![]() + 4NH3↑+H2O
+ 4NH3↑+H2O
(1)“氧化”阶段需在 80℃条件下进行,适宜的加热方式为__________________。
(2)NaClO 溶液与 Ag 反应的产物为 AgCl、NaOH 和 O2 ,该反应的化学方程式为________________。 HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是__________________________________________。
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并_______________________。
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3·H2O反应外(该条件下NaClO3与NH3·H2O不反应),还因为____________________________________________________________。
(5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:________________________(实验中须使用的试剂有: 2 mol·L-1水合肼溶液,1 mol·L-1H2SO4 )。
20. (14分)砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措 施之一。
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有![]() ,其原因是___________________________________。
,其原因是___________________________________。
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种 浓度之和的分数)与pH的关系分别如题20图- 1和题20图- 2所示。
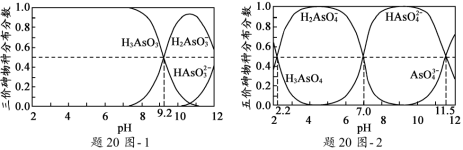
①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为_____________________。
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1 )。
H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1 )。
(3)溶液的pH对吸附剂X表面所带电荷有影响。pH =7. 1时, 吸附剂X表面不带电荷; pH > 7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如题20图-3所示。学科&网
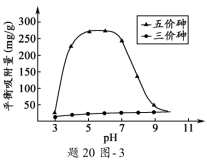
①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是____________________。
②在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为___________。 提高吸附剂X对三价砷去除效果可采取的措施是____________________________________。
21. (12 分)【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A. [物质结构与性质]
铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为____________________。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
)分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
(3)C、H、O 三种元素的电负性由小到大的顺序为________________。
(4)乙醇的沸点高于丙酮,这是因为____________________。
(5)某FexNy的晶胞如题21图-1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n) CunNy。FexNy转化为两种Cu替代型产物的能量变化如题21图-2 所示,其中更稳定的Cu替代型产物的化学式为___________。

B. [实验化学]
1-溴丙烷是一种重www.ccutu.com要的有机合成中间体,沸点为71℃,密度为1.36 g·cm-3。实验室制备少量1-溴丙烷的主要步骤如下:
步骤1: 在仪器A中加入搅拌磁子、12 g正丙醇及20 mL水,冰水冷却下缓慢加入28 mL浓H2 SO4 ;冷却至室温,搅拌下加入24 g NaBr。
步骤2: 如图所示搭建实验装置, 缓慢加热,直到无油状物馏出为止。
步骤3: 将馏出液转入分液漏斗,分出有机相。
步骤4: 将分出的有机相转入分液漏斗,依次用12 mL H2O、12 mL 5% Na2CO3溶液和12 mL H2O洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。

(1)仪器A的名称是_____________;加入搅拌磁子的目的是搅拌和___________________。
(2)反应时生成的主要有机副产物有2-溴丙烷和__________________________________。
(3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是___________________。
(4)步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是______________________________。
(4)步骤4中用5%Na2CO3溶液洗涤有机相的操作: 向分液漏斗中小心加入12 mL 5% Na2CO3溶液,振荡,____________,静置,分液。
化学试题参考答案
选择题(共40分)
单项选择题:本题包括10小题,每小题2分,共计20分。
1.C 2.A 3.A 4.B 5.D 6.B 7.C 8.C 9.B 10.D
不定项选择题:本题包括5小题,每小题4分,共计20分。
11.C 12.BC 13.B 14.AD 15.CD
非选择题(共80分)
16.(12分)
(1)Al2O3+ 2OH-![]() 2
2![]() + H2O
+ H2O
(2)减小
(3)石墨电极被阳极上产生的O2氧化
(4)4![]() + 2H2O-4e-
+ 2H2O-4e-![]() 4
4![]() +O2↑ H2
+O2↑ H2
(5)NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜
17.(15分)
(1)醚键 酯基
(2)取代反应
(3) ![]()
(4) 
(5)
18.(12分)
(1)①4CuCl + O2+ 8H2O![]() 2Cu2(OH)2Cl2·3H2O
2Cu2(OH)2Cl2·3H2O
②Fe2+
(2)n(Cl-)=n(AgCl)×![]() =
=![]() =4.800×10-3mol
=4.800×10-3mol
n(Cu2+)=n(EDTA)×![]()
=0.08000 mol·L-1×30.00 mL×10-3 L·mL-1×![]() =9.600×10-3 mol
=9.600×10-3 mol
n(OH-)=2n(Cu2+)-n(Cl-)=2×9.600×10-3 mol-4.800×10-3 mol=1.440×10-2 mol
m(Cl-)=4.800×10-3 mol×35.5 g· mol -1 =0.1704 g
m(Cu2+)=9.600×10-3 mol×64 g· mol -1 =0.6144 g
m(OH-)=1.440×10-2 mol×17 g· mol -1 =0.2448 g
n(H2O)=![]() =4.800×10-3 mol
=4.800×10-3 mol
a∶b∶c∶x = n(Cu2+)∶n(OH-)∶n(Cl-)∶n(H2O)=2∶3∶1∶1
化学式为Cu2 (OH)3Cl·H2O
19.(15分)
(1)水浴加热
(2)4Ag+4NaClO+2H2O![]() 4AgCl+4NaOH+O2↑
4AgCl+4NaOH+O2↑
会释放出氮氧化物(或 NO、NO2 ),造成环境污染
(3)将洗涤后的滤液合并入过滤Ⅱ的滤液中
(4)未过滤掉的溶液会稀释加入的氨水,且其中含有一定浓度的Cl-,不利于AgCl与氨水反应
(5)向滤液中滴加2mol·L-1水合肼溶液,搅拌使其充分反应,同时用1 mol·L-1 H2SO4溶液吸收反应中放出的NH3 ,待溶液中无气泡产生,停止滴加,静www.ccutu.com置,过滤、洗涤,干燥。
20.(14 分)
(1)碱性溶液吸收了空气中的CO2
(2)①OH- + H3AsO3![]() H2AsO3- + H2O ②2.2
H2AsO3- + H2O ②2.2
(3)①在pH7~9之间,随pH升高H2AsO4-转变为HAsO42-,吸附剂X表面所带负电荷增多,静电斥力增加
②在pH4~7之间,吸附剂X表面带正电,五价砷主要以H2AsO4-和HAsO42-阴离子存在,静电引力较大;而三价砷主要以H3AsO3分子存在,与吸附剂X表面产生的静电引力小
加入氧化剂,将三价砷转化为五价砷
21.(12 分)【选做题】
A. [物质结构与性质]
(1)[Ar]3d5或 1s22s22p63s23p63d5
(2)sp2和sp3 9 mol
(3)H<C<O
(4)乙醇分子间存在氢键
(5)Fe3CuN
B. [实验化学]
(1)蒸馏烧瓶 防止暴沸
(2)丙烯、正丙醚
(3)减少1-溴丙烷的挥发
(4)减少HBr挥发
(5)将分液漏斗下口向上倾斜、打开活塞排出气体