2018年吉林高考化学模拟冲刺试题【含答案】
第Ⅰ卷
一、选择题:本题共13小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.下列说法不正确的是
A.pH计不能用于酸碱中和滴定终点的判断
B.多孔碳可用作氢氧燃料电池的电极材料
C.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通 DNA链中的P元素
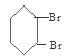
D. ![]() 和CO2反应生成可降解聚合物
和CO2反应生成可降解聚合物![]() ,反应符合绿色化学的原则
,反应符合绿色化学的原则
8.下列各项叙述中正确的是
A.将适量氯化铁饱和溶液滴入沸水中并不断搅拌可制得氢氧化铁胶体
B.若需要使用0.100mol/L的CuSO4溶液480ml,可用12g胆矾及相应容器配制
C.用分液漏斗、烧杯、漏斗架、饱和碳酸钠溶液可除去乙酸乙酯中的乙酸
D.实验室从海带里提取碘的过程是:灼烧、溶解、过滤、萃取
9.下列与金属腐蚀有关的说法正确的是
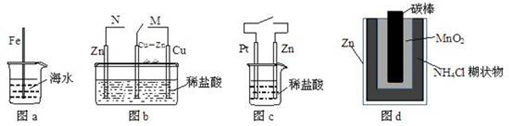
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
10.往1.0 mol·L-1KI溶液中加固体I2,发生反应:I2(aq)+I- (aq)![]() I3-(aq)△H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示。已知反应第一次达到平衡时用时10s,则下列说法正确的是
I3-(aq)△H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示。已知反应第一次达到平衡时用时10s,则下列说法正确的是
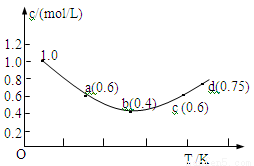
A.该反应的△H>0
B.a、c两点对应的I-反应速率相等
C.b点时0-10s内I-的平均反应速率为0.04mol·L-1·s-1
D.d点时该反应在对应温度下处于平衡状态
11. 在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
C.80℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L
D.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol/L,则此时v(正)>v(逆)
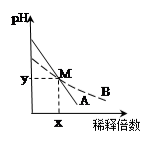 12.室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示。下列说法正确的是
12.室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示。下列说法正确的是
A.稀释前, c (A)> 10 c (B)
B.稀释前,A溶液中水电离出的OH - 浓度是B溶液中由水电离出的OH - 浓度的10倍
C.在M点,A、B两种碱溶液中阳离子的物质的量浓度相等
D.M点时A和B的浓度相等
13. 已知2SO2 (g) + O2 (g) ![]() 2SO3 (g);ΔH =-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2 ;(丙) 2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3 (g);ΔH =-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2 ;(丙) 2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是
A.c(SO2)与c(O2)之比k:k甲=k丙 > k乙
B.SO3的质量m:m甲=m丙 > 2m乙
C.容器内压强P:P甲=P丙 > 2P乙
D.反应放出或吸收热量的数值Q:Q甲=Q丙 > 2Q乙
26.(15分)氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。
I.现有0.001 mol·L-1酸性KMnO4溶液和未知浓度的无色NaHSO3溶液。反应的离子方程式是2MnO4- +5HSO3-+H+===2Mn2++5SO42- +3H2O。请完成下列问题:
(1)本实验________(填“需要”或“不需要”)使用指示剂,理由是 _。
(2)该滴定实验所需仪器有下列中的________。
A.酸式滴定管(50 mL) B.碱式滴定管(50 ml) C.量筒(10 ml) D.锥形瓶 E.铁架台 F.滴定管夹 G.烧杯 H.白纸 I.胶头滴管 J.漏斗
(3)不用________(填“酸”或“碱”)式滴定管盛放酸性KMnO4溶液,试分析原因
。
(4)滴定前平视KMnO4溶液液面,刻度为aml,滴定后俯视液面刻度为bml,则(b-a)ml比实际消耗KMnO4溶液体积______________(填“多”或“少”),如果滴定后仰视液面刻度为cml,计算得到的待测液浓度比实际浓度__________(填“大”或“小”)。
II.取Ce(OH)4产品0.5000g,加硫酸溶解后,用0.100 0 mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗20.00 mL标准溶液,该产品中Ce(OH)4的质量分数为_ 。
- (14分)今年10月中旬,雾霾天气肆虐长春。燃煤尾气和汽车尾气是造成空气污染的重要原因。
 (1)汽车尾气净化的主要原理为2NO(g)+2CO(g)
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随度(T)、催化剂的表面(S)和时间(t)的变化曲线如左图所示。据此判断:
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随度(T)、催化剂的表面(S)和时间(t)的变化曲线如左图所示。据此判断:
①在T2温度下,0~4 s内的平均反应速率 v(N2)= 。
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在图1(见答题卡)中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
③若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________________。
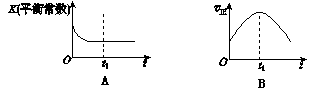
错误!未找到引用源。![]() (2)煤燃烧产生的烟气中有含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
(2)煤燃烧产生的烟气中有含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
①已知甲烷的燃烧热为900 kJ·mol-1;1 mol水蒸气变成液态水放热44 kJ;N2与O2生成NO的过程如下:
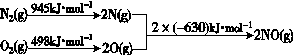
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=____________。
②在恒压下,将CH4(g)和NO2(g)置于密闭容器中,也可以发生化学反应:
CH4(g)+2NO2(g) ![]() N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有
N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有
_ 。
A.减小投料比[n(NO2)/n(CH4)] B.降低温度
C.增加原催化剂的表面积 D.增大压强
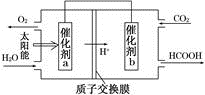
(3)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.下图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图.催化剂b表面发生的电极反应式为__ ,已知常温下,0.1mol/L的HCOONa溶液pH为9,则HCOOH的电离常数Ka=_ _。
28.(14分)运用化学反应原理分析解答以下问题:
(1)弱酸在水溶液中存在电离平衡,部分0.1 mol·L-1弱酸的电离平衡常数如下表:
弱酸 | 电离平衡常数(25 ℃) |
HClO | K=2.98×10-8 |
H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 K2=1.02×10-7 |
①当弱酸的浓度一定时,降低温度,K值________(填“变大”“变小”或“不变”)。
②下列离子方程式和有关说法错误的是____________。
a.少量的CO2通入次氯酸钠溶液中:2ClO-+H2O+CO2===2HClO+CO
b.少量的SO2通入碳酸钠溶液中:SO2+H2O+2CO===2HCO+SO
c.相同温度时,等物质的量浓度的三种弱酸与足量NaOH溶液完全中和消耗NaOH的体积为V(H2CO3)>V(H2SO3)>V(HClO)
d.相同温度时,等pH三种盐溶液的物质的量浓度关系:c(Na2CO3)<c(NaClO)<c(Na2SO3)
③亚硒酸(H2SeO3)也是一种二元弱酸,有较强的氧化性。往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式:___ 。
(2)工业废水中常含有一定量的Cr2O和CrO,它们对人类及生态系统会产生很大损害,必须进行处理后方可排放。
①在废水中存在平衡:2CrO(黄色)+2H+![]() Cr2O(橙色)+H2O。若改变条件使上述平衡向逆反应方向移动,则下列说法正确的是________。
Cr2O(橙色)+H2O。若改变条件使上述平衡向逆反应方向移动,则下列说法正确的是________。
a.平衡常数K值可以不改变
b.达到新平衡CrO的消耗速率等于Cr2O的消耗速率
c.达到新平衡后,溶液pH一定增大
d.再达平衡前逆反应速率一定大于正反应速率
②Cr2O和CrO最终生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) ![]() Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的Ksp=10-32,当c(Cr3+)降至10-3 mol·L-1,溶液的pH调至4时,________(填“有”或“没有”)沉淀产生。
Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的Ksp=10-32,当c(Cr3+)降至10-3 mol·L-1,溶液的pH调至4时,________(填“有”或“没有”)沉淀产生。
(3)已知:①2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
②CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
③CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
某温度下三个反应的平衡常数的值依次为K1、K2、K3,则该温度下反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)的化学平衡常数K=________(用含K1、K2、K3的代数式表示)。向某固定体积的密闭容器中加入3 mol CO和3 mol H2,充分反应后恢复至原温度,测定容器的压强为反应前的1/2,则CO的转化率为_________。
CH3OCH3(g)+CO2(g)的化学平衡常数K=________(用含K1、K2、K3的代数式表示)。向某固定体积的密闭容器中加入3 mol CO和3 mol H2,充分反应后恢复至原温度,测定容器的压强为反应前的1/2,则CO的转化率为_________。
36.【化学——选修2:化学与技术】(15分)
正极材料为![]() 的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
(1)橄榄石型![]() 是一种潜在的锂离子电池正极材料,它可以通过
是一种潜在的锂离子电池正极材料,它可以通过![]() 、
、![]() 与
与![]() 溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应投料时,不将![]() 和
和![]() 溶液直接混合的原因是 。
溶液直接混合的原因是 。
②共沉淀反应的化学方程式为 。
③高温成型前,常向![]() 中加入少量活性炭黑,其作用除了可以改善成型后的
中加入少量活性炭黑,其作用除了可以改善成型后的![]() 的导电性能外,还能 。
的导电性能外,还能 。
(2)废旧锂离子电池的正极材料试样(主要含有![]() 及少量AI、Fe等)可通过下列实验方法回收钴、锂。
及少量AI、Fe等)可通过下列实验方法回收钴、锂。
① 在上述溶解过程中,![]() 被氧化成
被氧化成![]() ,
,![]() 在溶解过程中反应的化学方程式为 。
在溶解过程中反应的化学方程式为 。
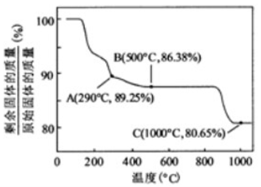
②![]() 在空气中加热时,固体残留率随温度的变化, 如右图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为 。(化学式)在350~400℃范围内,剩余固体的成分为 。(填化学式)。
在空气中加热时,固体残留率随温度的变化, 如右图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为 。(化学式)在350~400℃范围内,剩余固体的成分为 。(填化学式)。
37.【化学——选修3:物质结构与性质】(15分)
金属铝、铁、铜与人类生产、生活息息相关。
(1)聚合硫酸铁(简称PFS)的化学式为[Fe(OH)n(SO4)(3-n)/2]m是常用的水处理剂,与PFS中铁元素价态相同的铁离子的电子排布式为
(2)下列关于[Cu(NH3)4]SO4、K4[Fe(CN)6]、Na3A1F6的说法中正确的有____(填正确答案标号);
a.三种物质中含有的化学键类型均有离子键和配位键
b.[Cu(NH3)4]SO4中含有NH3分子,其水溶液中也含有大量NH3分子
c.三种物质的组成元素中第一电离能最大的是氮元素
d.K4[Fe(CN)6]与Na3AIF6的中心离子具有相同的配位数
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因____,
(4)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上的Cl原子的杂化轨道类型为 。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为____;
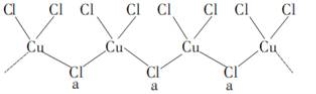
(5)用晶体的X射线衍射法可以测得阿伏加德罗常数的值。对金属铜的测定得到以下结果:铜晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.0g · cm-3,则铜原子的直径约为 .pm,阿伏加德罗常数的值为 (列式计算,结果保留三位有效数字)。
- 【化学一一选修5:有机化学基础】(15分)
I. 图为一种天然产物,具有一定除草功效。下列有关该化合物的说法错误的是( )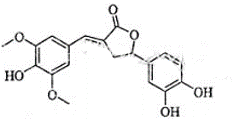
A.分子中含有三种含氧官能团
B.1 mol该化合物最多能与6molNaOH反应
C.既能与FeC13发生显色反应,也能和NaHCO3反应放出CO2
D.既可以发生取代反应,又能够发生加成反应
Ⅱ. l,6-己二酸(G)是合成尼龙的主要原料之一,可用含六个碳原子的有机化合物氧化制备。下图为A通过氧化反应制备G的反应过程(可能的反应中间物质为B、C、D、E和F):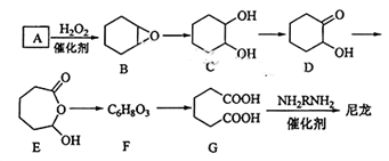
回答下列问题:
(1)化合物A中含碳87.8%,其余为氢,A的分子式为_____________。
(2)B到C的反应方程式为______________(不需注明条件,其他无机试剂任选)。
(3)F的结构简式为_____________。
(4)在上述中间物质中,核磁共振氢谱出峰最少的是__________,最多的是____。(填化合物代号)
(5)由G合成尼龙的化学方程式为___________________________。
(6)![]()
请参照上述合成路线流程图示例,写出由A通过两步反应制备1,3-环己二烯的合成路线为
2018年吉林高考化学模拟冲刺试题【含答案】
1-6BBADDB 7.A 8.C 9.B 10.D 11.D12. C13. B
26. 15分
(1) 不需要 Mn2+无色,MnO4- 为紫色,过量的MnO4-使无色溶液变为紫色
(2) A、D、E、F(G、H)
(3) 碱 酸性KMnO4溶液具有强氧化性,能腐蚀橡胶管 (4)少 大
(5) 83.20%
27.14分
(1)①0.0125 mol·L-1·s-1或0.0125 mol/(L·s)
②如图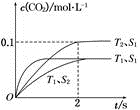
③AD
(2) ① ΔH=-1178 kJ/mol ②AB(3)CO2+2H++2e-=HCOOH 10-5mol·L-1
28.14分
(1)① 变小 ②ac ③H2SeO3+2SO2+H2O=Se↓+2H2SO4
(2)①ad ②没有
(3)K1K22K3 75%
36、(1)①![]() 在碱性条件下更易被氧化(凡合理答案均可);
在碱性条件下更易被氧化(凡合理答案均可);
②![]()
③与空气中![]() 反应,防止
反应,防止![]() 中的
中的![]() 被氧化 (凡合理答案均可)
被氧化 (凡合理答案均可)
(2)
①![]() ;
;
②![]() ;
;![]()
37、(1)1s22s22p63s23p63d5或[Ar]3d5(2分)
(2)ad(3分)
(3)sp3杂化(2分) K2CuCl3(2分)
(4)![]() 或255(3分) 6.05×1023(3分)
或255(3分) 6.05×1023(3分)
- 15分
I BC Ⅱ(1)C6H10 (2)略 (3)![]()
(4)F D E
(5)![]() ;
;
(6)![]()
![]()
![]()
![]()